структура на атома
Atom (от гръцката atomos - неделим) - едно ядро неделим химически химически частици елемент, свойствата носители на веществото. Веществата се състоят от атоми. Atom се състои от положително заредени ядро и отрицателно зареден електронен облак. Обикновено атом е електрически неутрален. Размер атом е напълно определя от размера на неговия електронен облак от размера на ядрото е пренебрежимо малък в сравнение с размера на електронен облак. Z ядро се състои от положително заредени протони (протон заряд съответства на един в произволни единици) и N неутрони, които не носят заряд (протони и неутрони наречен нуклоните). По този начин, ядрен заряд определя само от броя на протоните и е равен на поредния номер на елемента в периодичната таблица. Положителния заряд се компенсира ядро отрицателно заредени електрони (електронен заряд -1 произволни единици), които образуват електрон облак. Броят на електроните е равен на броя на протоните. Теглата на протони и неутрони са (съответно 1 и 1 атомни масови единици). атомна маса определя от масата на ядрото, тъй като масата на електрони е около 1850 пъти по-малка от масата на протон и неутрон и в изчисленията рядко се считат. Броят на неутроните може да се намери от разликата между масата на атома и броя на протоните (N = A-Z). Тип на атоми на химичен елемент със сърцевина, състояща се от строго определен брой протони (Z) и неутрони (N) се нарича нуклид.
заряд (произволни единици)
Тъй като ядрото на атома се концентрира почти цялата маса, но размерът му е незначително в сравнение с общия обем на атома, сърцевинния материал обикновено се приема, неподвижна точка в центъра на атома, и атомът се разглежда като електронна система. Когато химическата реакция не се влияе от атомното ядро (с изключение на ядрени реакции) като вътрешни нива на електрони и включва само външната електрони обвивка на електрони. Поради тази причина е необходимо да се знаят свойствата на електрона и правилата за формиране на електронните обвивки на атомите.
Преди изучаването на електронни свойства и правила за формиране на нивата на електрони, е необходимо да се обърне внимание на историята на формирането на идеи за строежа на атома. Ние няма да се покрие цялата история на създаването на атомната структура, и да се съсредоточи само върху най-спешни и най-много "истински" представи, които могат най-ясно показват как електроните са подредени в атома. Започват да се предлагат атома като основен елемент на материала е поела гръцката философия. След това, историята на атомната структура е преминала сложен път и различни идеи, като например неделимостта на атома, моделът Thomson на атома, и др. Най-близкото модел на атома е предложен от Ernest Rutherford през 1911. Той атом в сравнение с Слънчевата система, където слънчевата действал като основната атома и електроните се движат подобно на планетите около него. поставяне електрон на орбита е много важна стъпка в разбирането на структурата на атома. Въпреки това, като планетарен модел на атомната структура е в противоречие с класическата механика. Фактът, че движението на електрон в орбита трябваше да загубим потенциална енергия и най-накрая "падне" в ядрото на атома и трябва да престане да съществува. Този парадокс се елиминира чрез въвеждането на постулатите на Niels Бор. Според тези постулати на електрони се движат по орбити около неподвижна сърцевина и не се абсорбира и излъчваната енергия при нормални условия. Постулати показват, че законите на класическата механика не са подходящи за описване на атома. Такъв модел се нарича модел на атома Бор-Rutherford. Продължение на планетарен структурата на атома е квантово-механичен модел на атома, съгласно който ще разгледаме електрон.
Електрон е квази-частици, които показват двойственост вълна-частица. Той е едновременно частица (телце) и вълна. За свойства включват маса на частиците на електрона и заряд, и свойствата на вълната - способността да дифракция и смущения. Комуникацията между вълни и частици свойства на електрони отразени в уравнението на де Бройл на:
За електрон не може да се изчисли траекторията си, е възможно да се говори само за вероятността за намиране на електрона в дадено местоположение около ядрото. Поради тази причина, не говоря за орбитите на движението на електрона около ядрото, но на орбитали - пространството около ядрото, в които вероятността за намиране на електрона е по-голяма от 95%. точно в същото време това е невъзможно за един електрон за измерване на положението и скоростта (принцип неопределеността на Хайзенберг).
където Δ х - координата на несигурност електрон, Δ V измерване на скоростта -pogreshnost, Н = Н / 2π = 1.05 · 10 -34 J · S
Колкото по-точно да измерваме електрона координира, толкова по-голяма грешка при измерването на скоростта, както и обратното: колкото по-точно знаем, че скоростта на електрона, толкова по-голяма несигурност в своята координира.
Наличието на свойствата на вълната на електрона позволява прилага уравнението на вълната Шрьодингер.
където Е - общата енергия на електрона, на V потенциалната енергия на електрона, физическото смисъла на ф функция - корен квадратен от възможността за намиране на електрона в пространство с координира х. Y и Z (сърцевината се счита за произхода).
Представлявано от уравнението написана за системата един електрон. За системи, които съдържат повече от един електрон, за да опише принципа остава един и същ, но уравнението става все по-сложно. Графично разтвор на уравнението на Шрьодингер е геометрията на атомна орбитала. Тъй като S-орбиталния е сфера, р-орбитален а - осем форма с "възел" в основата (на ядрото), където вероятността за намиране на електрон клони към нула.
В рамките на съвременната квантова-механична теория на електрони е описан от набор от квантови числа: п. л. мл. S и MS. Съгласно принципа на Паули изключване на един атом не може да бъде два електрона с напълно идентичен набор от квантово число.
В главно квантово число определя нивото на енергия на електрона, което е, на какво ниво е електронен електрона. Основният квантовата номер може да бъде единствено число стойности по-големи от 0: п = 1; 2; 3. Максималната стойност на п за специфичен елемент атом съответства на броя на периода, в който елемент се намира в периодичната таблица на Менделеев.
Orbital (по избор) квантово число л определя геометрията на електронен облак. Това може да отнеме цели числа от 0 до п-1. За стойности на допълнително наименование квантовата номер л писмо използва:

тип орбитали на различни нива на енергия (за различни п)
Електрони орбитали и нивата не са поставени на случаен принцип, но от Klechkovskii правило. при което електрони пълнене се извършва в съответствие с принципа на минималната енергия, тоест в порядъка на увеличаване на размера на основната и орбитални квантово число п + л. В случая, когато количеството на пълнене за двата варианта на същото, първоначално изпълнен с най-ниското ниво на енергия (например, когато п = 3 и L = 2 и п = 4 и L = 1 първоначално попълнено ще бъде ниво 3). магнитно квантово число мл на определя орбитално място в пространството и може да стойност цяло число от -L до + л включително 0 до S-орбитали възможно само една стойност мл = 0. За Р-орбитите на три стойности -1, 0 и +1, т.е. р-орбитален могат да бъдат разположени по три координатните оси X, Y и Z.
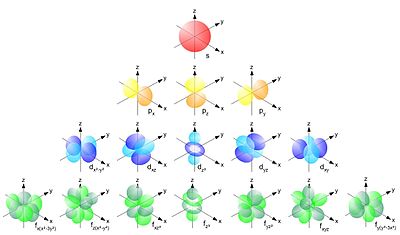
местоположението на орбитите, в зависимост от стойността на мл
Electronic разполага със собствен ъглов момент - спин квантово число се обозначава с. електронно Сервиз - постоянна и равна на 1/2. обратно явление може да бъде традиционно представен като движение около оста си. Първоначално електрон спин се отъждествява с движението на планетата около оста си, но такова сравнение не е наред. Spin - чисто квантово явление, което няма аналог в класическата механика.