Какво е молекула, протеин
Съгласно първичната структура на протеина се разбира количеството и реда на редуване на аминокиселинни остатъци, свързани заедно чрез пептидни връзки в полипептидната верига.
полипептидната верига има в единия край съдържа свободна, които не участват в образуване на пептидна връзка, NH2-rpyna, тази част се нарича N-край. На противоположната страна е свободен, не участва в образуването на пептидната връзка, НООС група е - С-края. По време на началото на веригата се получи N-края, е тук, че започва номерирането на амино киселинни остатъци:
Аминокиселинната последователност на инсулин избран F. Sanger (Университет на Кеймбридж). Този протеин се състои от две полипептидни вериги. Една верига се състои от 21 аминокиселинни остатъци, различни верига - на 30. вериги са свързани чрез два дисулфидни мостове (Фигура 6).
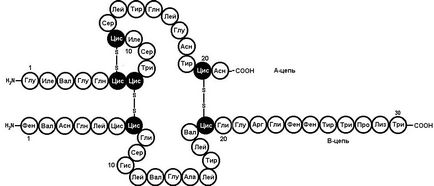
Фиг. 6. Първична структура на човешки инсулин
От стенограмата на тази структура е бил прекарал 10 години (1944 -. 1954 GG). В момента основната структура на много протеини, се определя, процесът на определяне на автоматизиран и не представлява сериозен проблем за изследователите.
Информация за първичната структура на всеки протеин е кодиран от ген (ДНК част) и приложени по време на транскрипция (копиране на информация на тРНК) и транслация (синтеза на полипептидната верига). Във връзка с това е възможно да се установи първичната структура на протеина също е известна структура съответния ген.
Тя може да се види на таксономични видове отношения на първичната структура на хомоложни протеини. Чрез хомоложни протеини включват протеини, които имат различни видове същата функция. Такива протеини имат сходни аминокиселинни последователности. Например, цитохром С протеин в повечето видове има относително молекулно тегло от около 12 500 и съдържа около 100 аминокиселинни остатъци. Разликите в първичната структура на цитохром С са пропорционални на два вида на филогенетичен разликата между тези видове. Така кон цитохром С и дрожди се различават в 48 аминокиселинни остатъци, пиле и патици - два, цитохроми като пилета и пуйки са идентични.
Вторичната структура на протеин формира чрез образуване на водородни връзки между пептидни групи. Два вида на вторична структура: α-β-спирална структура (или сгънати слой). Протеините, които не могат вторична структура, също са налични части на полипептидната верига.
α-спиралата е оформена като пружина. При образуването на α-спирала на всеки кислороден атом на пептидната група образува водородна връзка с водороден атом през четвъртата верига NH-групи:
Всяка спирала своя страна е свързан с още няколко спирална намотка водородни връзки, което дава структурата на значителна сила. а-спирална има следните характеристики: диаметър на спиралата на 0.5 пМ, стъпка - 0.54 пМ на ход на спиралата за 3.6 аминокиселинни остатъци (Фигура 7.).

Фиг. 7. Модел на а-спирала, което отразява неговите количествени характеристики
Амино киселина странични групи, насочени навън от спиралата (фиг. 8).
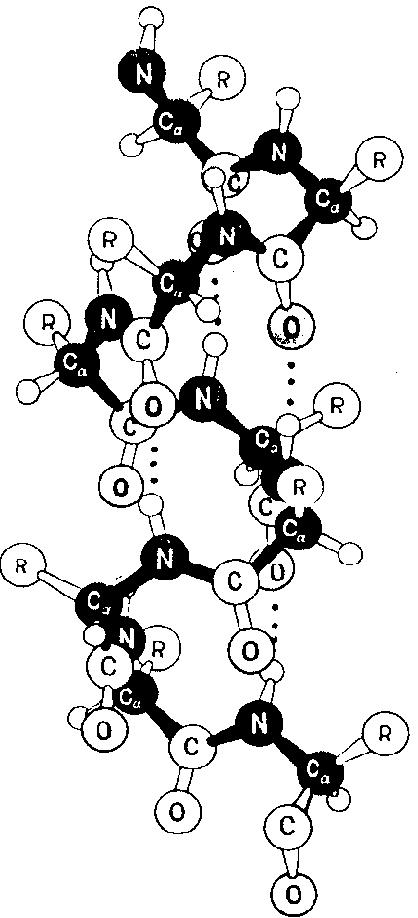
Фиг. 8. спирала модел, отразяващ пространственото подреждане на странични вериги
Природни L-амино киселини може да бъде изграден като дясната и лявата спирала. За повечето естествени протеини, характерни за спиралата на дясно. На D-аминокиселини и може да бъде конструиран като лява и дясна спирала. Същата полипептидна верига, състояща се от смес от D-и L-аминокиселинен остатък не може да образува спирала.
Някои аминокиселинни остатъци предотвратяват образуването на α-спирала. Например, ако един ред във веригата няколко положително или отрицателно заредени аминокиселинни остатъци, като част решава а-спирални структури, поради взаимното отблъскване на подобни заредени радикали. Възпрепятстват образуването на радикали спирала аминокиселинни остатъци с големи размери. Пречка за образуването на α-спирала, е присъствието в полипептидната верига на пролинови остатъци (фиг. 9). В пролинов остатък при азотния атом образува пептидна връзка с друга аминокиселина, не е водороден атом.
Фиг. 9. пролинов остатък предотвратява образуването на спирала
Следователно остатък пролин е част от полипептидната верига не е способен да образува на междуверижна водородна връзка. В допълнение, азотният атом в пролин е част от твърд пръстен, което прави невъзможно да се върти около комуникационна N - C и спирала формация.
Също така е описано α-спирала, и други видове спирали. Въпреки това, те са рядкост, предимно на къси разстояния.
Образуването на водородни връзки между съседните групи пептидни фрагменти полипептидна верига води до образуването на β-структура или сгънати слоя:
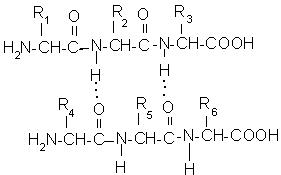
За разлика от α-спирала сгънати слой има зигзагообразна форма, подобна на акордеон (фиг. 10).
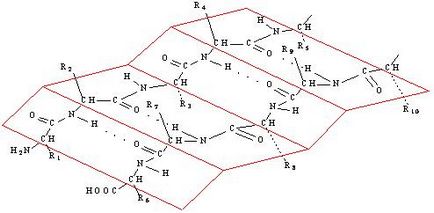
Фиг. 10. Структурата на β-протеин
Разграничаване успоредни и антипаралелни сгънати слоеве. Паралелното β-структура са оформени между частите на полипептидната верига, чиито посоки съвпадат:

Antiparalelnye Р-структури са образувани между срещуположно насочени региони на полипептидната верига:
Р-структури могат да бъдат образувани между повече от две полипептидни вериги:
Като част от някои протеини вторична структура може да бъде осигурена само α-спирала в други - само Р-структури (паралелни или антипаралелни, или и двете, и други) в трета заедно с а-spiralized части могат да присъстват и β-структура.
Много протеини vtorichnoorganizovannye структура (α-спирала -структура) сгънати по определен начин в компактен глобули. Пространствената организация на глобуларни протеини се нарича третичната структура. По този начин, третичната структура характеризира триизмерно подреждане на секциите на полипептидна верига в пространството. При образуване на третичната структура са включени йонни и водородни връзки, хидрофобни взаимодействия, ван дер Ваалс сили. Стабилизиране третичната структура на дисулфидните мостове.
Третичната структура на протеините, определени от тяхната аминокиселинна последователност. В своето съобщение формация може да възникне между аминокиселини в полипептидната верига, която се намира на значително разстояние. В разтворими протеини полярни амино радикали са склонни да се появяват на повърхността на протеинови молекули и най-малко - в молекулата, хидрофобните радикали са компактно опаковани в глобули образуващ хидрофобен регион.
Понастоящем третичната структура на много протеини инсталиран. Да вземем два примера.
съхраняване на кислород в мускулите - миоглобин - свързващ протеин с относително тегло 16700. Нейната функция кислород. В молекула има една полипептидна верига, състояща се от остатъци 153 аминокиселини и хем, който играе важна роля в кислород свързване.
Пространствената организация на миоглобин, създаден чрез дейността на Dzhona Kendryu и неговите колеги (фиг. 11). В молекулата на протеина съдържа осем а-спирална региони, които представляват 80% от всички аминокиселинни остатъци. Миоглобин молекула е много компактен, може да се вмести в общо четири водни молекули, почти всички полярни остатъци на аминокиселини са разположени върху външната повърхност на молекулата, повечето от хидрофобните радикали в молекулата е близо до повърхността е хем - небелтъчен група, отговорни за свързването на кислород.
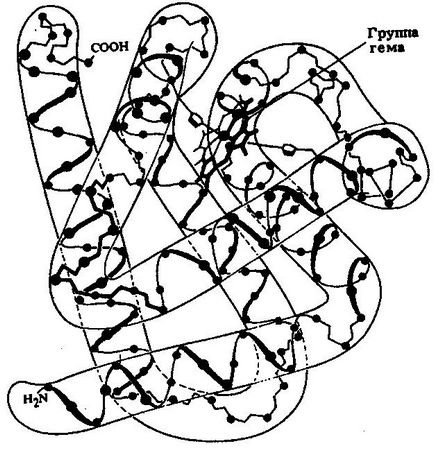
Фигура 11. Третичната структура на миоглобина
Рибонуклеазен - кълбовидни протеини. Той се секретира от клетките в панкреаса, е - ензим, който катализира разцепването на РНК. За разлика миоглобин, рибонуклеаза молекула има много малко а-спирална региони и достатъчно голям брой сегменти, разположени в β-конформация. Трайност на третичната структура на протеин дисулфидни връзки за получаване на 4.
Много протеини се състоят от няколко, два или повече протеинови субединици, или като молекули, които имат специфични вторични и третични структури, държани заедно от водородни връзки и йонни връзки, хидрофобни взаимодействия, ван дер Ваалс сили. Тази организация на протеиновите молекули се нарича кватернерна структура. и нарича се олигомерни протеини. Индивидуални субединици, или протеинова молекула, като част от олигомерен протеин, наречен протомери.
Броят на протомери в олигомерни протеини може да варира в широки граници. Например, креатин киназа се състои от две протомери хемоглобин - от 4 протомери, РНК полимераза E.coli - ензим, отговорен за синтеза на РНК, - от 5 протомери, пируват дехидрогеназа сложни - от 72 протомери. Ако протеинът се състои от две протомери, тя се нарича димер, четири - тетрамер, шест - хексамер (Фигура 12).. Повечето от протеина в олигомерна молекула съдържа 2 или 4 протомер. Съставът на олигомерен протеин може да включва същите или различни протомерите. Ако част от протеин протомера се състои от две идентични, е - хомодимер. ако е различен - хетеро.
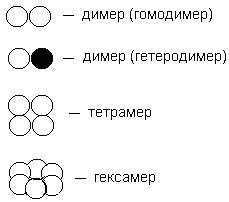
Фиг. 12. Олигомерните протеини
Помислете за организацията на молекулата на хемоглобина. Основната функция на хемоглобина е за транспортиране на кислород от белите дробове до тъканите и въглероден двуокис в обратна посока. (. Фигура 13) му молекула се състои от четири полипептидни вериги, две различни видове - две а-вериги и две бета-вериги и хем. Хемоглобинът е протеин близък миоглобина. Вторични и третични структура на миоглобина и хемоглобина протомери са много сходни. Всяка протомер, съдържащ хемоглобин, миоглобин като 8 а-spiralized части на полипептидната верига. Трябва да се отбележи, че първичните структури на миоглобина и хемоглобин протомер идентични остатъци само 24 аминокиселини. Следователно, протеини, които са значително по-различни в първичната структура могат да имат подобен пространствена организация и изпълнява подобни функции.
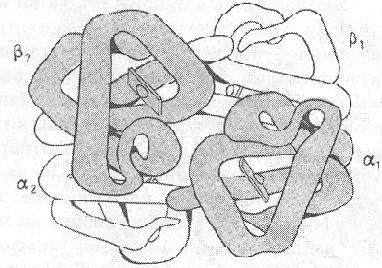
Фиг. 13. Структурата на хемоглобин