Основни термодинамични процеси блог за енергия
Основните процеси в термодинамиката са:
- Хелмхолц. протичащ при постоянен обем;
- изобарен. протичащ при постоянно налягане;
- изотермичен. се провежда при постоянна температура;
- адиабатно. където топлообмена с околната среда отсъства;
- политропно. удовлетворява уравнението PV п = CONST.
Изохорен, изобарен, изотермичен и адиабатни процеси са особени случаи на политропно процес.
В проучването на термодинамичните процеси се определя от:
- уравнение Метод в р-V-S и т координира;
- Връзка между параметрите на състоянието на водата;
- промяната във вътрешната енергия;
- стойност на външен работа;
- Обобщавайки количеството топлина, за изпълнението на процеса или количеството топлина, отвлечено.
изохорен процес
Когато изохорен процес, състоянието V = конст.
От уравнението на състоянието на идеален газ (PV = RT) следва:
газ под налягане .. Т.е. е пряко пропорционална на неговата абсолютна температура:
Работа разширяване изохорен процес е нула (л = 0), тъй като обемът на работния флуид не се променя (Δv = конст).
Количеството топлина подава към работния флуид в процеса при 1-2 CV = конст се определя от формулата:
Т. k.l = 0, въз основа на първия закон на термодинамиката Δu = р. и по този начин изменението на вътрешната енергия може да се определя по формулата:
Промяната в ентропията в изохорен процес се определя от формулата:
изобарен процес
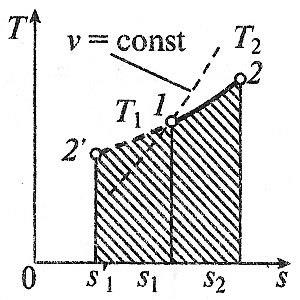
Това се нарича изобарен процес срещащи се при постоянно налягане р = конст. От идеален закон газ slueduet на:
т. е. в обема на изобарен процес газ пропорционална на неговата абсолютна температура.
Работата ще бъде равен на:
Количеството топлина в ср = конст се определя от формулата:
Промяната на ентропията ще бъде равен на:
изотермичен процес
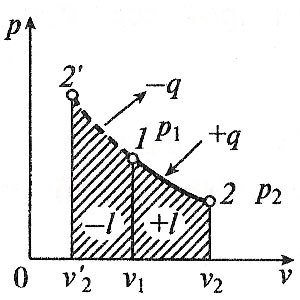
Когато процес изотермични работна температура течност остава постоянна Т = конст, следователно:
.. Т.е. налягане и обем са обратно пропорционално един до друг, така че изотермични компресия на повишаване на налягането на газ, и по време на разширение - се намалява.
Процесът на работа ще бъде:
Тъй като температурата остава постоянна, и вътрешната енергия на идеалния газ в изотермични процес остава постоянно (Δu = 0) и подава към всички топлината на работния флуид е напълно превръща в работа на разширяване:
За изотермичен компресия на работната течност освободената топлина в обем от работа, прекарано на компресия.
Промяната на ентропията е:
адиабатен процес
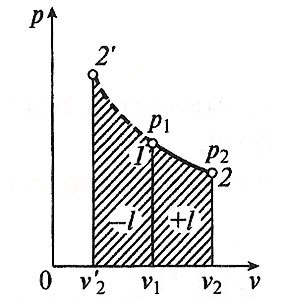
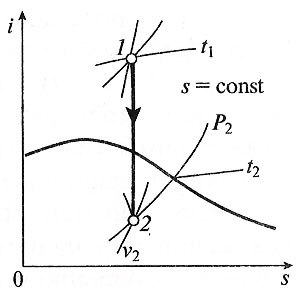
Процес, наречен адиабатни промени в газ държава, която proiszodit без топлообмен с околната среда. Тъй като DQ = 0, то уравнението на първия закон на термодинамиката за адиабатно процес ще изглежда така:
В адиабатен процес на работата на разширение е направено само за сметка на вътрешната енергия на потреблението на газ, и компресията, което възниква в резултат на действието на външни сили, цялата работа се извършва от тях, за да се увеличи на вътрешната енергия на газа.
Означаваме специфичната топлина в адиабатен процес през градината. и DQ условие = 0 изразена както следва:
Това състояние показва, че специфичната топлина в адиабатен процес е равна на нула (= 0 градина).
и уравнение на адиабатен процес крива (адиабатно) в п, о -diagram има формата:
В този израз, к се нарича адиабатно индекс (както се нарича съотношение на Поасон).
Стойностите на индексите adiabatykdlya някои газове:
kperegretogo двойка = 1.3
kvyhlopnyh вътрешно горене газове = 1.33
knasyschennogo влажна пара = 1.135
От предишната формула:
Технически процес на работа адиабатно (ltehn), равен на разликата (i1-i2) енталпиите начало и край на процеса.
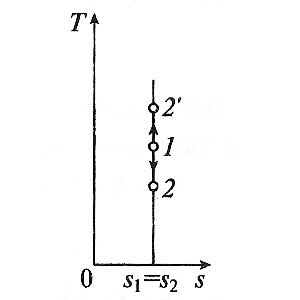
Адиабатно процес случва без вътрешно триене в работната течност, се нарича изоентропен. В T, S -diagram тя е представена с вертикална линия.
Обикновено действителните адиабатни процеси работят в присъствието на вътрешно триене в работния флуид, при което топлината се разпределя винаги, който комуникира с работна течност. Тогава DS> 0, а процесът се казва действителната адиабатен процес.
политропно процес
Това се нарича политропно метод, който е описан по уравнението:
политропно индекс п може да има стойност в диапазона от -∞ до + ∞, но този процес е постоянна.
От уравнението на политропно процес и Clapeyron уравнение може да се получи експресия, за създаване на връзката между р, V и Т на всеки две точки на политропно:
Работата на разширяване на газа в политропно процес е:
В случай на тази формула на идеален газ може да бъде превърнато:
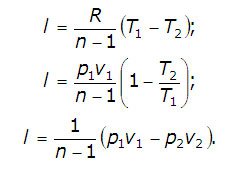
Обобщителни или номер, определен в жегата на процеса се определя от първия закон на термодинамиката:
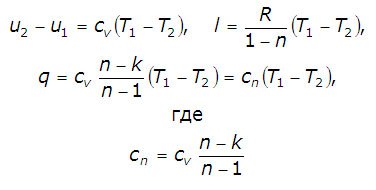
Тя представлява специфичната топлина на идеален газ в политропно процес.
Когато CV. к и п = конст CN = конст обаче политропно процес понякога се определя като процес на постоянна специфична топлина.
Политропен процес е обобщение на стойността за покриване на съвкупността от основните термодинамични процеси.
Графично представяне polytrope в р, о координира, в зависимост от политропно индексът п.
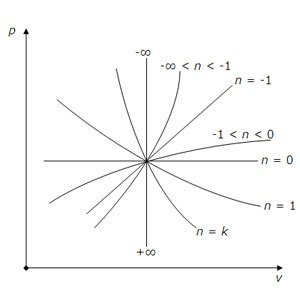
PV 0 = конст (п = 0) - Isobar;
PV = конст (п = 1) - изотерма;
р 0 V = конст, стр 1 / ∞ V = конст, PV ∞ = конст - isochore;
п> 0 - хиперболичен криви,