Урок - Сяра - просто вещество
1) Са 0 0 + Cl2 = Са 2 CI -1 2 R-I съединение
2) KCl + Br2 = р и не т. А. Cl> Br
1) Ba 0 0 + F2 = Ва + 2F2 -1 PN съединение
2) NaBr + I2 = р и не т. За. Вг> I
II. Работата по темата на урока. Проучване Въпроси. даден на екрана.
- Име на елемент
- Позицията на серен атом в периодичната система на химичните елементи
- Физични свойства. флотация
- Алотропна модификации сяра
- Химичните свойства на сяра
- Сяра в природата
- Значение приложение сяра.
1. История на елемента. Сега е възможно да се определи, когато дадено лице е първият изложени на сяра и неговите съединения. Това се случи преди много време. Тя помогна на нашите предци, за да получите по-скоро огъня искри, когато поразен от kresalom фрагмент от пирит. Използвайте го, за приготвяне на бои и козметика. Те го знаеше и древните индийци, които са дали името - "Ваше Величество" - означава "жълт". Символът на химически произлиза от латинската дума "Сяра". Древните римляни, наречени сяра "жлъчен бог Вулкан" (покровител на пожар). Картината Karla Bryullova "Помпей".
2. Да разгледаме ситуация на елемент на сяра в таблица на химичните елементи.
а. Пишем на елемент характеристика в бележника - дело на студенти от периодичната таблица на химичните елементи, с допълнителна проверка на изпълнението.
б. Да се изготви модел на атомната структура с електронен позиция - тази работа се извършва на магнитна дъска.
инча Пишем имейла и графичен формула.
е да се направят изводи за окисление на серен елемент.
3. Физичните свойства на сяра - прост вещество.
Трябва да бюра чанти, внимателно се обърнеш и да погледнем нещата. Проверете своята връзка с вода - Внимателно изсипете съдържанието на чантата на цялата повърхност на водата, без да се разбърква (в инструктивен карта - Референтен 1). Ние се направят изводи от наблюдения: сяра - жълто твърдо вещество, в основното състояние на "плава" на повърхността на водата, докато с плътност по-голяма от вода.
"Флотация" - (FR.) - Това свойство се основава на различни повърхност омокряемост, в този случай вода и сяра на прах е метод за обогатяване на полезни изкопаеми.
Виж поведението на сяра спрямо други разтворители - алкохол. Има малко разтворим. Демонстрация на учителите.
4. Серен Например да разгледаме отново природния феномен - алотропия.
Има много познати модификации на сяра с циклична или линейна молекулна структура на различните състави. Нека разгледаме цифрите: те се проектира върху екран
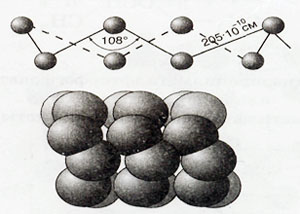
Структура S8 молекула и структурата на модела на ромбично сяра
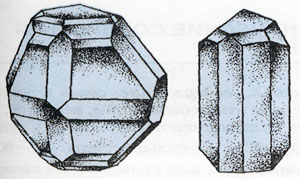
Кристални модификации на сяра:
Ляво - ромбич. Право - моноклинна
Серни 3 модификации: ромбично, моноклинна и пластмаса. За причина на серни алотропия е различна кристална структура на модификация. Най-стабилен - ромбично сяра, където молекулата се състои от 8 атома в пръстена затворен - S8.
Ние наблюдаваме експеримента. Загрява се на прах сяра в пламък дух лампа. Стопената течната сяра, в тънка струя, разливи внимателно в чашата на студена вода. Ние се пластмаса сяра.
5. Да разгледаме химичните свойства на сяра - прост вещество.
1. Изгарянето на сяра. Аз съм в ръцете на всички познатия обект - кутия кибрит. Запалете мач. Миризма - миризмата на газ, който се образува по време на горенето и се нарича сяра - серен диоксид. Уравнението за тази реакция:
S 0 = 0 + O2 S + 4O2 -2 Създаване на електронна везна.
Н2 0 + S 0 = S Н2 1 -2 - сероводород газ е отровно вещество образува в резултат на разпадане на органичните съединения. Той се говори - гнило яйце мирис на сероводород.
3. Реакция на сяра с метали - образуването на сулфиди:
а. Na 0 + S = 0 Na2 1 S -2. За това уравнение да се направи електронна везна.
б. Hg 0 + S 0 = S Hg 2 -2. Тази реакция е от практическо значение. Методът се нарича - demercurization - отстраняване и неутрализация на разсипания живак.
За да обобщим, сярата в реакции с кислород и метали показват различни степени на окисление на 4 и -2.Yavlyayas редуктор и окислител.
За да се консолидират. до уравнения серни реакции с алуминий и цинк.
5. Сяра в природата. Сега малко почивка, нека "извличане на сяра." Вие имате в ръцете на приятелски и устройство - памучни тампони. Когато в организма сярата и защо имаме нужда от нея? Точно така, от храната. Ето някои от тях: грах, яйца, овесени ядки. Обсъдете с учениците на въпроса.
Отидете на работа с подаяния. Среща с проби от естествени минерали, които съдържат сяра.
Независима работа с устройствата за картини и учебник таблица 8 на страница 98 (в учебна карта - на Задача 2). За студенти са дадени проби от нативния сяра и неговите сулфидни и сулфатни съединения: пирит, галенит, халкопирит, гипс.
6. Използването и ролята на сяра. Едно изобретение на човечеството със сяра, сте видели днес - това е един мач. А сега погледнете този дизайн - гърне, което съдържа три компонента, най-горния камък. И това е от значение за нашата тема, историята разказва, че накара Надзорния и разбира се, компетентно лице за изобретяването на оръжия.
прилагане на сяра са разнообразни, ще научите за приготвяне на домашна работа. Ние обсъждаме това в следващия урок.
За да обобщим нашия урок. Въвеждане на - сив - да ви даде много нови и интересни факти. Изградили сме съществуващите си умения. Желая Ви успешна работа в дома на инструкциите.
Домашна работа. Претенция 21 upr.3.4 стр.99. Намери отговора на въпроса: защо в серни ушите?
Изпълнете някоя от предложените предложения:
- Най-интересното в клас за мен е ....
- Най-безинтересна в клас за мен е ....
- Научих ....
- Сега, бихте искали да научите повече ....
- Ми хареса ....
- Бих искал да ви кажа ....
- Това беше най-скучния в урока.
- Ще го запомня ....
1 задача. Внимателно се разшири чантата с сиво. Помислете за пасивно признаци на веществото: физическо състояние, цвят; След това внимателно се излива върху повърхността на водата в чашата. Да не се намесва! Направят изводи за връзката на сяра вода (неговата плътност, разтворимост).
2 задача. Да разгледаме примери за природни минерали, съдържащи сяра. С помощта на таблицата 8 на страница 98 на учебника, пише в тетрадка името и минерална формула.